1) GPX4 通过减少谷胱甘肽 (GSH) 来减少脂质氢过氧化物造成的毒性;
2) FSP1 是不依赖谷胱甘肽的铁死亡抑制因子,它作为氧化还原酶,在细胞膜上将辅酶 Q (CoQ) 还原为泛醇 (CoQH2),CoQH2 作为一种捕获自由基的亲脂性抗氧化剂,可以抑制脂质过氧化物。但近期美国 MD 安德森癌症中心甘波谊教授团队在 Nature 上发表的文章 “DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer” 揭示了第三种铁死亡抑制机制。这项研究证实了线粒体二氢乳清酸脱氢酶 (DHODH) 介导的铁死亡防御机制,并且提出了通过抑制 DHODH 治疗癌症的新策略。
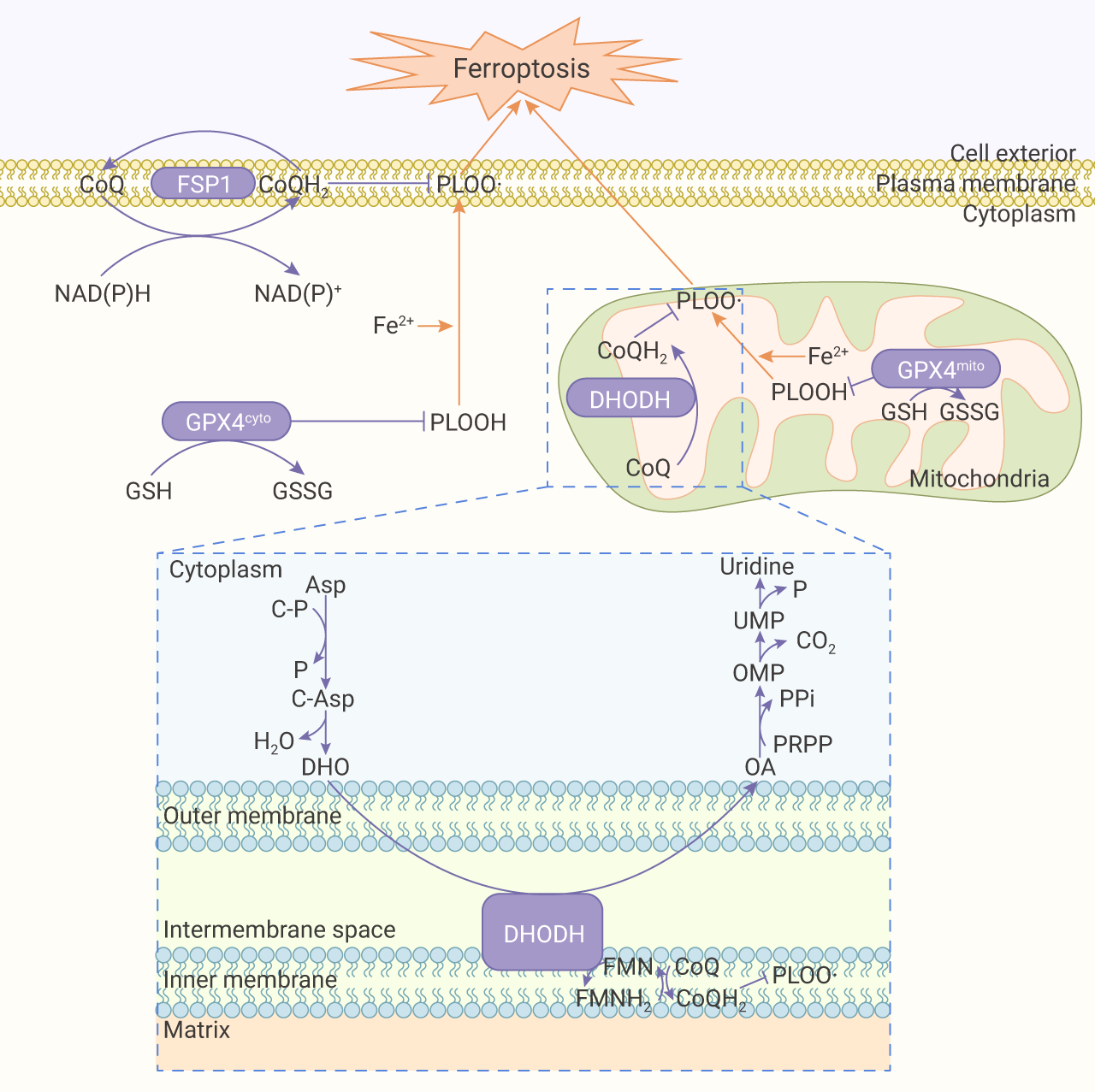
图 1. GPX4、FSP1 和 DHODH 的铁死亡抑制机制[1]
■ DHODH 参与铁死亡的调节
作者团队通过代谢组学分析发现,在癌细胞中用 GPX4 抑制剂 RSL3 或 ML162 处理会导致 N-氨基甲酰-L-天冬氨酸 (C-Asp,嘧啶生物合成的中间体) 显着消耗,并伴随尿苷 (Uridine; 嘧啶生物合成的最终产物) 的积累,然而铁死亡抑制剂 (Liproxstatin-1) 能够降低 RSL3 处理后增加的 15N-UMP(尿苷-15N2 5'-单磷酸) 的水平 (图 2a-b)。另外,通过用 C-Asp 补充细胞实验表明二氢乳清酸 (DHO,DHODH 的底物) 抵抗 GPX4 的抑制作用,而乳清酸 (OA,DHODH 的产物) 增强细胞对 GPX4 抑制剂的敏感性。然而,补充尿苷并不影响细胞对 GPX4 抑制剂的敏感性 (图 2c)。综上,作者团队发现 DHODH 参与了细胞铁死亡的调节,而且底物 DHO 和产物 OA 对铁死亡的敏感性相反,说明 DHODH 可能以独立于嘧啶核苷酸合成功能的方式调节铁死亡。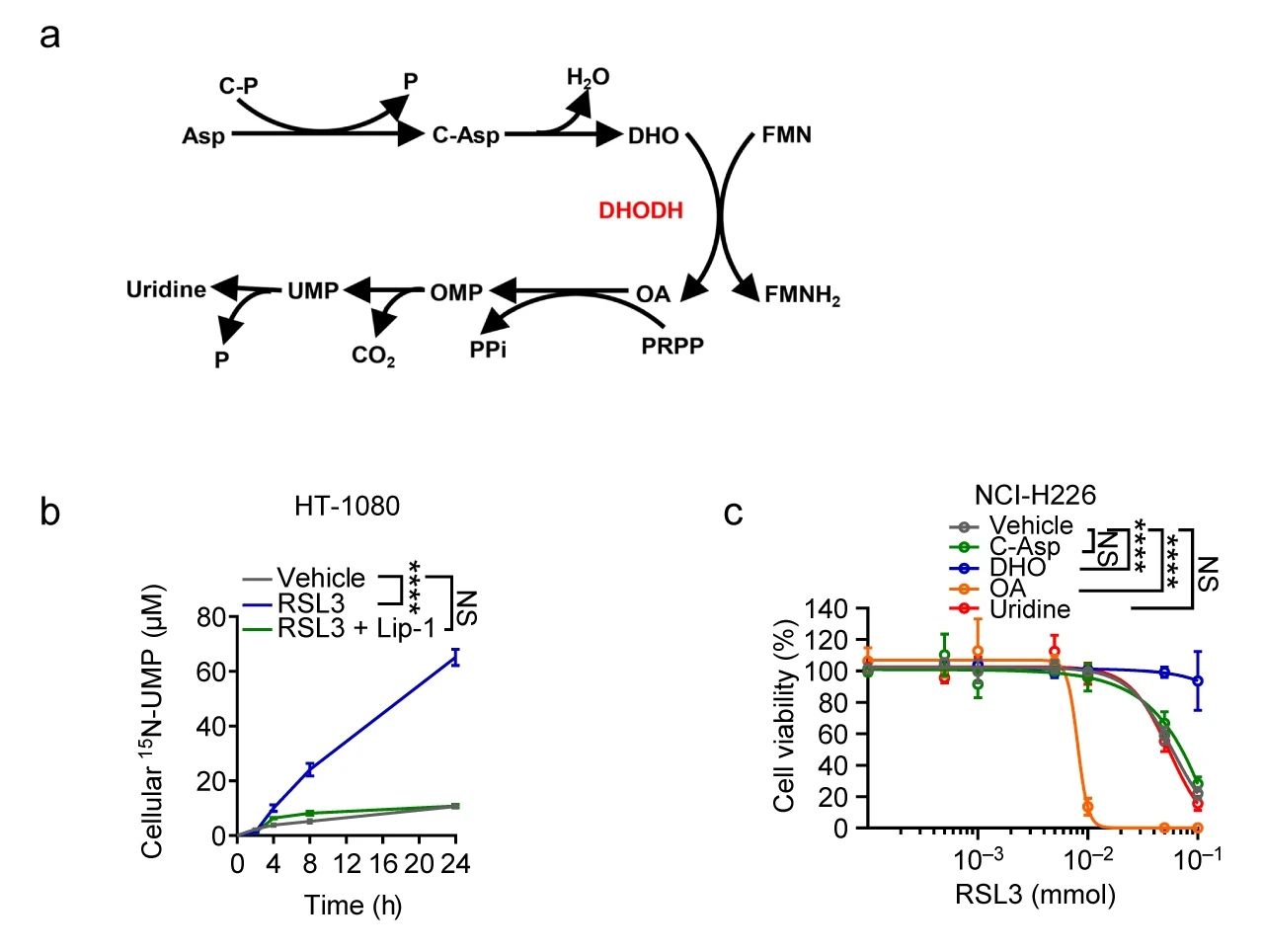
图 2. a: 嘧啶生物合成途径的简化示意图; b: RSL3 和/或 Liproxstatin-1 (Lip-1) 处理的 HT-1080 细胞中的 15N-UMP 水平; c: 对照、C-Asp、DHO、OA、uridine 预处理后,RSL3 处理 NCI-H226 细胞的活力[1]
作者团队对一组 GPX4high 和 GPX4low 癌细胞系的实验分析表明, GPX4low 癌细胞通常对 DHODH 抑制剂 Brequinar (BQR) 更敏感 (图 3a-b)。另外,Liproxstatin-1 在很大程度上挽救了 GPX4low NCI-H226 细胞中抑制 DHODH 诱导的细胞死亡,而用 BQR 未明显诱导 GPX4high HT-1080 细胞铁死亡。同时,抑制 DHODH 在 GPX4low 癌细胞中可以诱导强效脂质过氧化 (图 3c-d) 和铁死亡标记基因 PTGS2 的表达,而在 GPX4high 癌细胞中则没有,这可能是 GPX4low 癌细胞对 DHODH 抑制剂敏感的原因。
此外,抑制 DHODH 可增强细胞对 class 2 铁死亡诱导剂 (RSL3 和 ML162;抑制 GPX4 活性) 和 class 1 铁死亡诱导剂 (Sulfasalazine 和 Erastin;阻断 SLC7A11 介导的胱氨酸转运) 的敏感性。综上,抑制 DHODH 会诱导 GPX4low 癌细胞中的铁死亡,也会使 GPX4high 癌细胞对铁死亡敏感。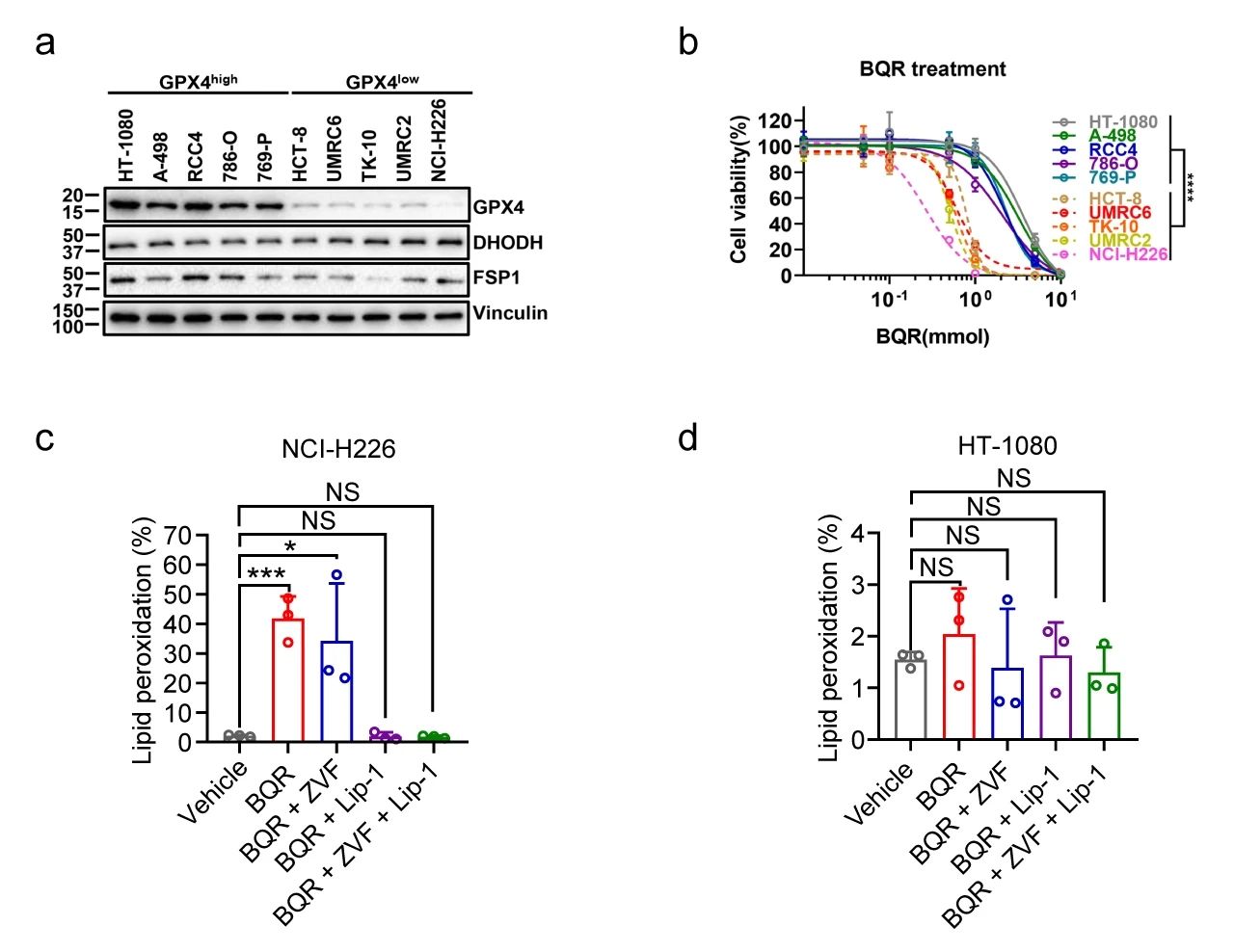
图 3. a: 不同癌细胞系中的 GPX4、DHODH 和 FSP1 蛋白水平; b: 不同剂量的 BQR 对 GPX4high 和 GPX4low 细胞活力的影响; c-d: 对照、Z-VAD-FMK (ZVF) 和/或 Lip-1 预处理后,BQR 处理的 NCI-H226/HT-1080 细胞中的脂质过氧化情况[1]先前的研究表明,DHODH 的表达与对 GPX4 抑制剂的抗性相关。作者团队通过在 GPX4high HT-1080 细胞和 GPX4low NCI-H226 细胞中HT-1080、b: shGPX4 HT-1080、c: NCI-H226 异种移植的肿瘤体积[1]总结:
作者团队发现至少存在三种铁死亡抑制机制,他们在亚细胞结构上都有独特的地位:胞质和线粒体中的 GPX4、质膜上的 FSP1 和线粒体中的 DHODH。
DHODH 和线粒体 GPX4 构成了两个主要的防御性武器,消除线粒体中的脂质过氧化物,其中一条路走不通了,都会迫使细胞更依赖于另一条路,当两条路都堵死了,就会触发主要由线粒体脂质过氧化导致的铁死亡。重要的是,这篇文章提出,通过 DHODH 抑制剂靶向铁死亡是潜在的癌症治疗方法。




